Contents
臨床研究とは?
臨床研究とは、医療機器の安全性・有効性を人を対象に確認するための研究、すべてのことを指します。
この定義の中には、治験も含まれるので、初めて臨床研究を実施する研究者は特に、治験との違いが分かりづらいかもしれません。
臨床研究の中でも「医療機器の安全性・有効性を人を対象に確認するための研究」を医療機器承認の目的のために実施する臨床研究のことを指します。
治験のことを「臨床試験」と呼び、「臨床研究」と区別する場合もあります。
臨床研究の種類
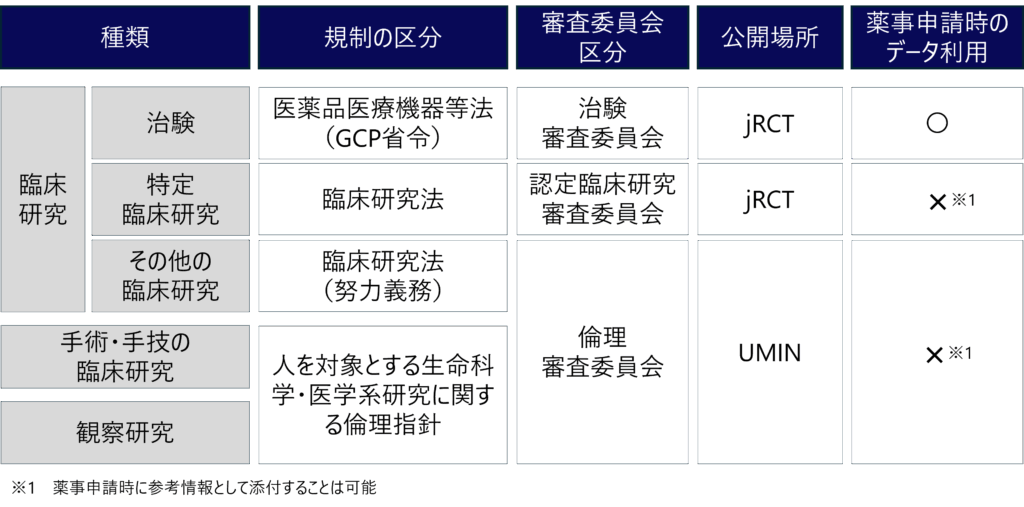
医学系研究中には、大きく分けて3種類の研究(臨床研究、手術・手技の臨床研究、観察研究)があります。そのうち、「介入」を伴う研究は臨床研究と呼ばれます。
介入とは、予防・診断・治療・看護ケア及びリハビリテーションなどについて下記の行為を行うことを指します。
厚生労働省:臨床研究に関する倫理指針
- 通常の診療を超えた医療行為であって、研究目的で実施するもの
- 通常の診療と同等の医療行為であっても、被験者の集団を原則として2群以上のグループに分け、それぞれに異なる治療法、診断方法、予防方法その他の健康に影響を与えると考えられる要因に関する作為または無作為の割付けを行ってその効果などをグループ間で比較するもの
観察研究とは、研究の目的で検査、投与その他の診断または治療のための医療行為の有無及び程度を制御することなく、患者のための最も適切な医療を提供した結果としての診療情報又は試料の収集により得られた情報を利用する研究のことを指します。
臨床研究を実施する目的
医療機器を開発するときは、研究開発の時点で基礎研究や試作品の開発など研究のPDCAを回す必要があります。
人でないと評価できない安全性・有効性がある場合は、治験ではなく臨床研究を活用するとよいでしょう。
相談窓口
実施したい研究はどの研究種別に該当するのかについては、下記相談窓口を活用して確認してください。
②認定臨床研究審査委員会
※最寄りの医療機関又は臨床研究を実施しようと考えている医療機関に設置された委員会に相談してください。
③臨床研究推進センター or 倫理審査委員会
※最寄りの医療機関又は臨床研究を実施しようと考えている医療機関に設置された相談窓口に相談してください。
臨床研究の主な流れ(特定臨床研究の場合)
臨床研究を実施していく際の一般的な流れをまとめます。ただし、実施する医療機関によって提出書類等はことなる可能性がありますので、基本的には医療機関に設置された審査委員会の指示に従ってください。
医療機関によっては、実施計画書や同意書等のひな型が準備されているケースもありますので、相談と同時に確認しておくとよいです。
基本的には、むやみやたらに臨床研究を開始することは推奨されていないので、臨床研究を実施するときは下記ポイントを確認したうえで、準備を開始してください。
- 過去の研究・論文で確認されていない事項である
- 人でないと評価できない項目がある
- 観察研究では評価ができない
準備段階
- 実施計画及び研究計画書の作成
- 認定臨床研究審査委員会の審査
- 実施医療機関の管理者の許可
- 実施計画の厚生労働大臣への提出(DB上での手続き)
- jRCT(Japan Registry of Clinical Trials)でのDB公開 ★ここまで完了して「研究開始」
特定臨床研究実施中の対応
- 疾病等発生時の対応
- 定期報告
- モニタリング
- 監査(リスクレベルに応じて実施)
- 計画変更(必要な場合)
- 中止届出(必要な場合)
- 主要評価項目のDB記録・公表
- jRCT(Japan Registry of Clinical Trials)での総括報告書のDB記録・公表 ★ここまで完了して「研究終了」
よくある疑問点
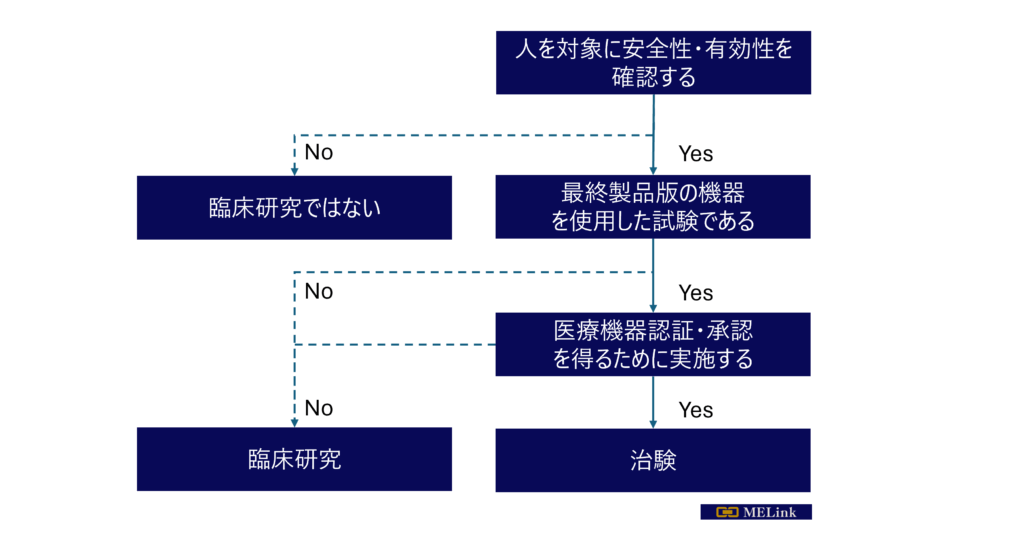
Q1:今医療機関にて人を対象に研究をしているが、これが臨床研究なのか治験なのか分からない
判別フローチャートで確認を!
研究者の方が陥るポイントとして、今実施中の臨床研究は治験に該当するのかそうでないのかを誤認しているケースがあります。
今実施している研究が臨床研究なのか、治験なのかを判定する簡易フローチャートを作成しましたので、ご確認ください。
どの審査委員会に審査してもらっているかでも判別はできます。治験の場合は、各病院に設置されている倫理委員会だけではなく、PMDAに「治験計画届出」をしているはずなので、そうでないならそれは臨床研究とも言えます。
PMDAとの相談の中で、「治験」が必要が否かという重要な論点がありますが、今やっている臨床研究がその代わりになることはまずないことは留意しておく必要があります。
Q2:未承認医療機器で臨床研究は実施できるの?
可能です。
2010年の医薬食品局長通知および2011年の同通知のQ&Aに関する監視指導・麻薬対策課長通知の発出により、一定の要件(臨床研究等)を満たす場合には、「医師等が主体的に実施する妥当な臨床研究への未承認医療機器の提供などには医薬品医療機器等法が適用されない」(薬機法に準拠してなくても違反ではない)ことが明記されています。
厚生労働省 (平成30年4月6日)臨床研究において使用される未承認の医薬品、医療機器及び再生医療等製品の提供等に係る医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律の適用について
Q3:臨床研究に係る費用はどのくらい?
治験以外の臨床研究の費用は、一般的に審査手数料、計画書・同意書等作成費用、モニタリング・監査依頼料、被験者への負担軽減費用等が考えられます。そのほかに、協力いただける医師に対して研究費用も提供する場合もあるかもしれません。
■計画書・同意書等の作成
計画書・同意書等の作成については、委託する場合もありますが、研究グループ内で対応することが可能です。医療機関においては、ひな型を用意してくれている場合があるので、臨床推進センター等で確認してください。症例数を決定する上で必要な統計情報についても、相談窓口を設置してくれている場合がありますので、そちらも活用するとよいです。
■モニタリング・監査依頼料
臨床研究に直接関係のない人が担当者に就く必要がありますが、モニタリング担当者の条件には、特殊な資格は必要ありませんので、研究グループ内で対応すること可能です。その場合は、e-learnigや講習でモニタリングの研修を受ける必要があります。こちらも臨床推進センター等で無料相談を受け付けているところがありますので、活用してください。
■審査手数料
東京大学の場合は、審査手数料は新規申請で20万(2025年10月25日時点)となっています。

■負担軽減費(謝金)
被験者として参加してくださる方に対して、臨床研究(治験など)への参加に伴う、交通費などの時間的・経済的負担を軽減するために被験者に支払われる費用です。
通院: 1回あたり7,000円〜10,000円程度、入院: 1泊あたり10,000円〜20,000円程度が目安です。
Q4:過去に実施された他の臨床研究を調べたい
jRCTで調べることが可能です。このDBには治験も登録されています。