
Contents
はじめに
こんな疑問を持つ方のために
- 医療機器開発は未経験で右も左も分からない
- 研究を医療に生かしたいが、販売するまで何をすればいいのか分からない
- 医療機器メーカー出身ではないけど、自分でもできるだろうか
- 資金を集めてコンサルティングを依頼しないと医療機器開発はできないのか
この記事を読むことでわかること
- 基礎研究から医療機器を販売する過程までの道のりが分かる
- 道のりを理解することで、今日からの方向性が決まる
- 医療機器開発事業の計画概要を作成できるようになる
エンジニアの エンジニアによる エンジニアのための医療機器開発情報サイト
MELinkでは、スタートアップで医療機器開発リーダーを務めてきた経験や知識を基に、皆さまのお役に立つ情報を発信しています。
エンジニア自身の独学でも医療機器開発はできる
医療機器とは
医療機器という言葉の定義は「人や動物に使用する機器」ではない
医療機器という言葉は、「人や動物に使用する機器」や「医療現場で使うもの」を指している言葉ではありません。
日本であれば、医療機器という言葉は、「医薬品,医療機器等の品質,有効性及び安全性の確保に関する法律(医薬品医療機器法)」という法律で定められたものの総称です。
医療機器という言葉の定義はエンジニア視点から見ると少し特殊で、機械原理は同じでも使う目的が違うだけで、医療機器にも医療機器でないものにもなってしまいます。
医療機器開発の出発点は「開発機器は法律的に医療機器だろうか?」という疑問に答えを出すこと
医療機器開発の第0ステージは、「医療機器かどうか」を確定することです。そしてその証拠をそろえていくことです。
最初にこれを確認することで、
- 医療機器以外選択肢がない(確実に医療機器にしなければいけない)
- メーカーが想定する使用目的によっては医療機器でもそうでなくてもOK
- 医療機器には該当しない
など、最初の分岐点を確認することができます。
医療機器かどうかは「人や動物の命がかかっているか」「医療を提供する目的があるか」で判断
スマートウォッチを例に考えてみます。最近いろんな企業がスマートウォッチを出しており、ものによっては脈拍や血中酸素濃度が図れるものもあります。
その機能を使う目的が「健康な方のライフスタイルをより良いものにする」というものであれば、医療機器にはならず、「命の危険がある人に適切な医療を提供する」というものであれば、医療機器になります。
医療機器でないものは、厳密な測定は求められず、大体の値が出ていれば問題ありませんが、医療機器の場合はその機器が正確な情報を提供できなければ命が危うくなりかねません。
そのため、メーカーは開発した機器が医療を提供する目的で作るのか、そうでないのかを最も最初に考える必要があります。
医療機器の該当性を公的機関に確認し確定
先ほど、医療機器かどうかは「人や動物の命がかかっているか」「医療を提供するか」で判断すると言いましたが、最終的な判定を出すのは公的機関になります。
公的機関が最終判断出すなら医療機器になるかならないか決めてもらえばいいと思う方もいらっしゃると思いますが、すべての機器において公的機関が決定を下してくれるわけじゃありません。
今までの世にない新しい機器であれば尚更です。その機器について世界で一番詳しいのはメーカーや開発したエンジニアなので、エンジニアは、医療機器に該当する(又は該当しない)という意見とその証拠を基に公的機関と相談し、国に最終判断をしてもらう必要があります。
医療機器に該当するかどうかを確認する方法は、こちらに詳しくまとめてあるので、ぜひ読んでみてください。
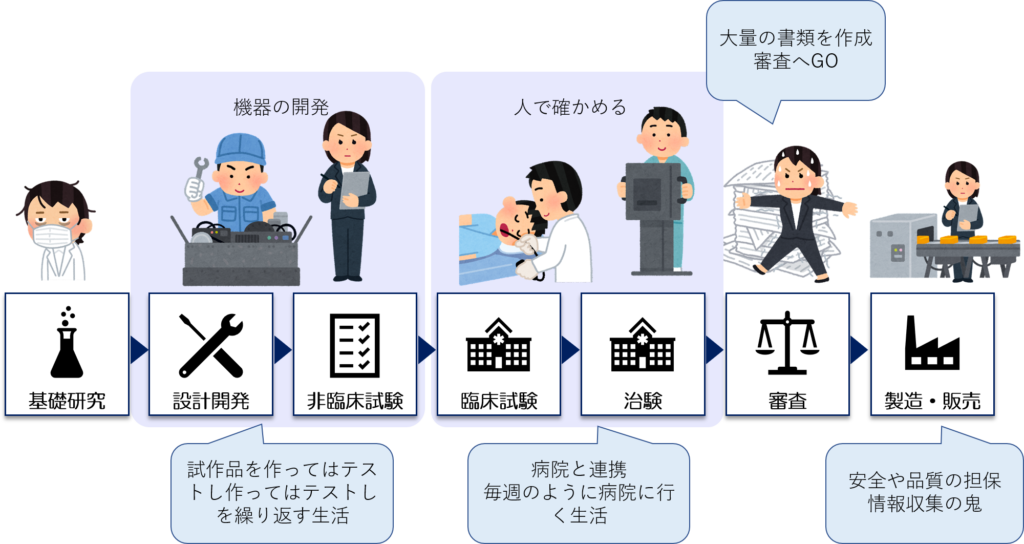
医療機器開発の全体の流れには大きく分けて5つの工程がある
医療機器開発には、一般的に以下の5つで構成されています。
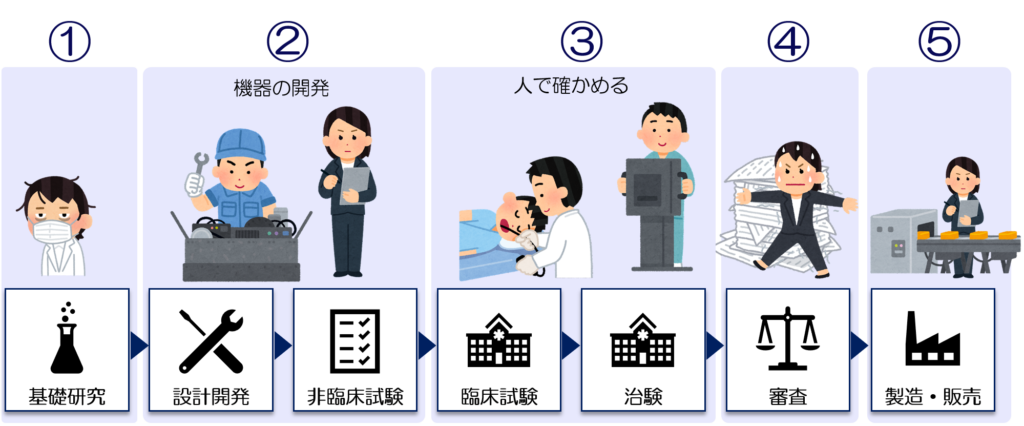
最初の工程 「基礎研究」
一番最初の工程は「基礎研究」です。
医療機器の試作品として形になる前の要素技術の開発段階ですね。
アカデミックから医療機器開発をスタートする方は、すでに終了している場合が多いかと思います。
これからどの分野の医療機器を開発するか迷っている方は、この段階からスタートになります。
基礎研究の段階では「試作品」を作らないでください!
エンジニアが良く間違いがちなポイントです。
早く試作品作って要素技術に問題がないか試したい気持ちは十分よくわかります。
ですが、その後の法律順守が危うくなってしまいますので、注意してください。
試作機を作る工程 「機器の開発」
この工程からは、お待ちかねの「試作品」を作り始めます。
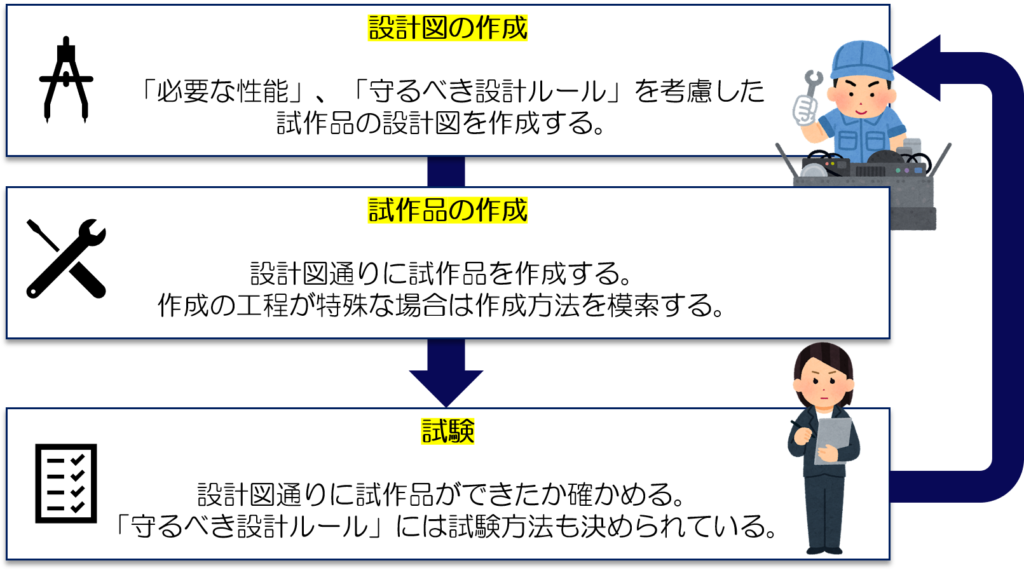
この工程は3つの段階に分けられます。
- 設計図の作成
- 試作品の作成
- 試験
設計図作成の段階では、機器の安全性や性能の目標値を決めます。
出来上がった試作品を使って、目標値がクリアできているか確認します。
目標値に届いていない場合は再度設計図の作成からやり直していきます。
3つの段階を繰り返し行うことで、最終形態まで機器を仕上げていくわけですね。
医療機器には必ず守らないといけない「設計のルール」があります。
設計図を作成する段階で、そのルールを確認しておきましょう。
医療機器を作ったことが無いエンジニアからすると、その設計ルールに従えばいいのでありがたい存在です。ただし、法律的な硬い文章で書かれているので、気力が必要です。
機器開発の工程から、決まった手順で決まった書式を使った「記録と保管」が必要になってきます。
なぜなら、この段階から④の「審査」対象になるからです。
実際に人で確かめてみる 「臨床試験」
機器の種類によって、患者さんに参加していただき確かめるものもあれば、医療関係者に試してもらうものもあるかと思いますが、
患者さんに参加していただく試験を「臨床試験」といいます。
臨床試験は、法律を遵守し安全面で問題ないか、患者さんに参加していただくほど重要な試験か、という点などを専門の委員会で審査してもらい、問題ないと許可もらえれば実施できます!
「臨床試験」は、患者さんに直接的・間接的に参加してもらう場合などがあります。
大きく3つの種類に分かれています。
- 観察研究
- 臨床研究
- 治験
それぞれ内容はこのようになっています。

人で試験することを広義の意味で臨床試験と呼びますが、その中でも新しい機器(新薬を含む)を医療機器として承認してもらう審査の際に添付できるデータを取ることを「治験」と呼びます。
エンジニア視点から見るとやってることは同じに見えてしまうので、「臨床研究」と「治験」を混同しがちですので、要注意です!
医療機器として許可もらうための「審査」
この工程では、これまで記録してきた機器開発のすべてを基に、医療機器として使う許可をいただきます。
医療機器の種類によって、審査に必要な情報が変わったり、審査機関が変わったりしますがどのルートでも緊張の時期です。
国内での審査機関は下記の2つがあります。
- 登録認証機関(民間企業)
- PMDA(厚生労働大臣)
また、許可の種類は3つあります。
- 承認申請(PMDA)
- 認証申請(登録認証機関)
- 届出(PMDA)
審査機関や許可の種類については、別の記事で詳しく解説しますので、参考にして下さい。
どの機関でどの審査をしてもらう必要があるかは、機器開発最初に考えます。
このような「薬事戦略」によって未来が大きく変わることがあるので、要注意です!
情報収集の鬼と化す工程「製造・販売」

この工程では、医療機器を生産して出荷していく他に、とにかく情報収集を徹底的に行う必要があります。
製造工程にリスクはないか、意図せぬ事態が起こっていないか、出荷した機器は病院などで問題を起こしていないか、類似機器が学会などで取り上げられていないかなどです。
アカデミック出身の方の場合、工場の運営や品質管理などほとんどの方が経験したことないと思うので、右も左も分からないという方も少なくないはず。
そんな時、意外にも味方になるのは、法律や規制です。品質管理方法は、法律や規制で細かく決められているからこそ、忠実に実施すれば問題ないわけです。
このサイトでは、品質管理の方法についても詳しく解説していくので、参考にしてください。
研究成果を医療で生かすまでの方法
いかがでしたでしょうか。
この記事では、医療機器開発の経験がない方でも分かるように研究成果を医療で生かすまでの方法を簡単にまとめました。
日本のエンジニアが持つ高い技術と、最先端の研究成果は、今後の世界の医療を大きく変えます。
そんな素晴らしい未来を「やり方が分からない」とかであきらめて欲しくないんです。
このサイトでは、今後もエンジニアのために特化した医療機器開発の情報を発信していきますので、
是非あなたの研究成果や技術を医療に役立ててください!








