医療機器開発ロードマップ【無料配布中】
MELinkでは、「医療機器開発のロードマップ」資料を無料で配布しています。
この資料を見れば、医療機器開発が初めての方や薬事経験のない方でも全体像を把握することができるように作りました。是非参考にしてください。

医療機器開発の流れ

■STEP1.調査
兎にも角にも、現状調査。まずは、こちらを調査及び整理していきましょう。
-
市場調査・ニーズ調査
-
競合製品の調査
-
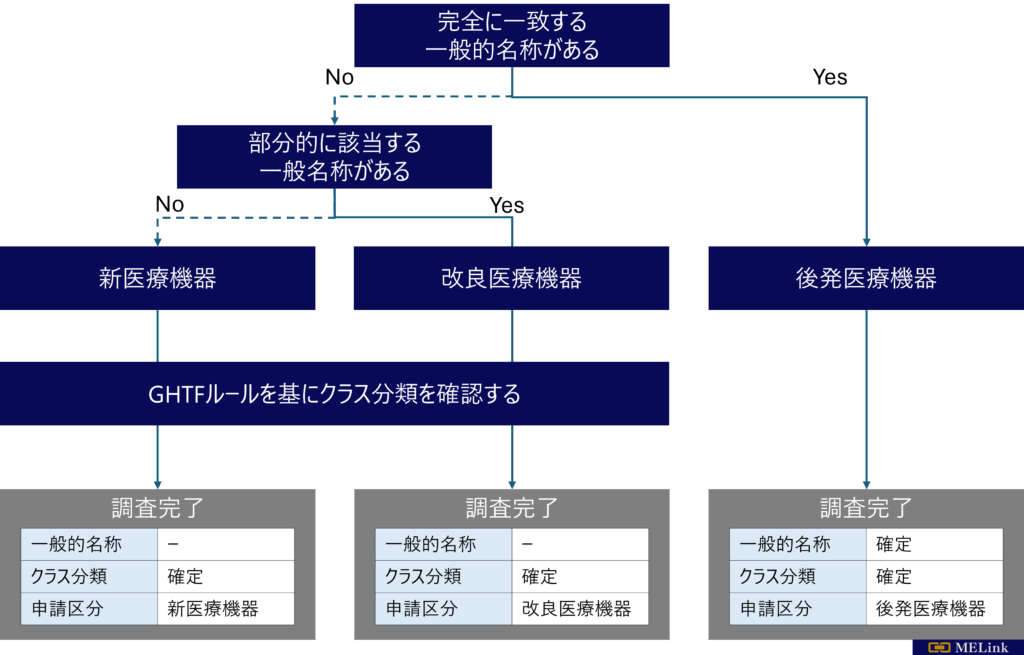
医療機器に該当するかの確認(医療機器該当性調査)
-
クラス分類調査
-
医療機器開発プロセスの確認
〇事業計画書ができている
市場やニーズ、競合情報を基に作成が完了している
〇医療機器該当性・クラス分類・申請分類が定まっている
自社見解を整理し、PMDA相談にて確認を行っている
■STEP2.研究開発
いわずもがな、要素技術の開発や検証を行います。
-
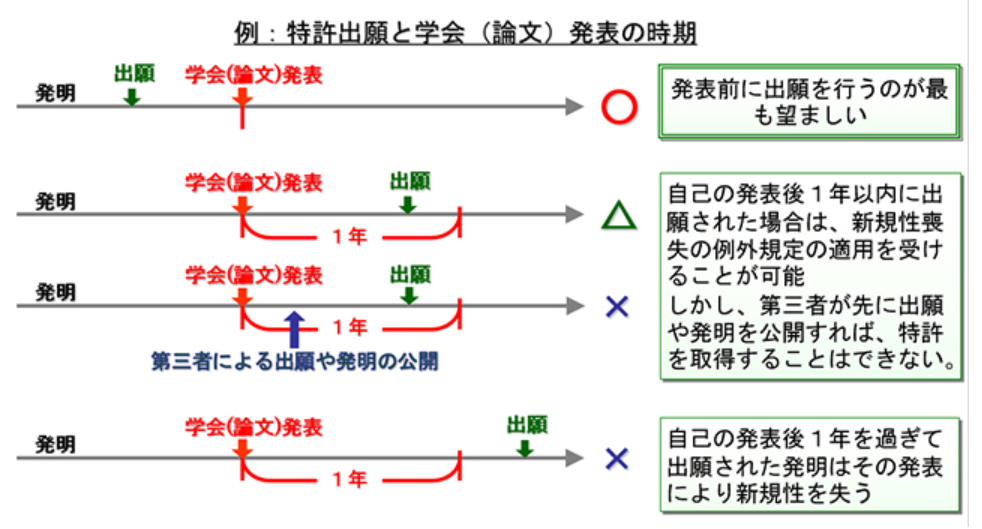
基礎研究
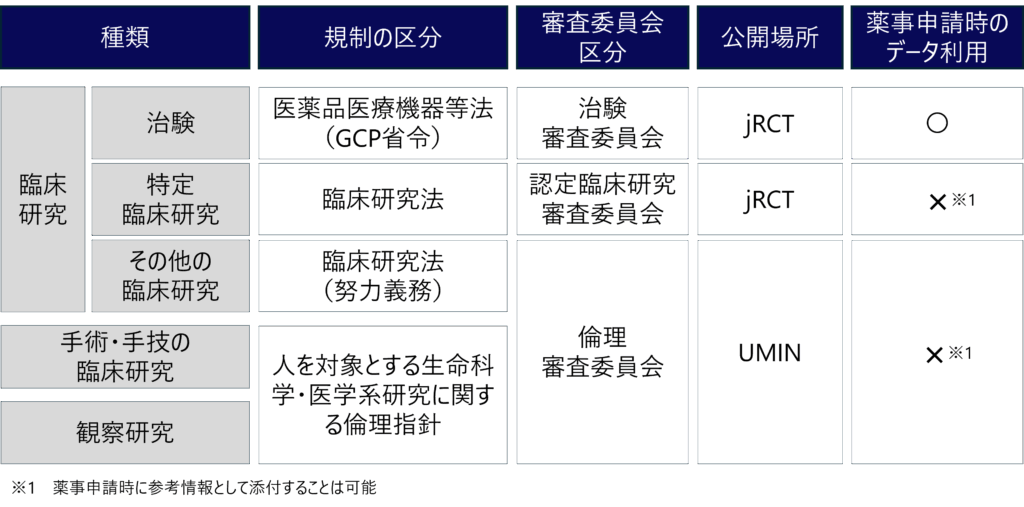
- 臨床研究
〇基礎研究が終了し、試作機での臨床研究が完了している
人に対して、安全性や有効性がある程度確認できている
■STEP3.量産機器設計・試験
このSTEPからが本格的な医療機器開発の始まりです。
法規制・基準をクリアした最終製品を設計・作成していきます。
-
設計・開発
-
品質管理体制構築(QMS体制)
-
非臨床試験
- 臨床試験(治験)
〇QMS省令に基づいた品質管理体制が整っている
最終製品の設計計画から試験計画・結果までがすべて記録されている
〇非臨床試験・臨床試験が完了している
■STEP4.審査
医療機器として認めてもらうための審査を受けます。
また、保険適用を希望する場合は、このタイミングでの申請となります。
-
承認・認証申請
-
QMS適合性調査対応
- 保険適用申請
〇承認・認証を得ている
〇保険適用を得ている
■STEP5.製造・販売
医療機器の製造・販売を開始できます。
また、市場に出た製品の安全管理をしていくことも重要になります。
-
製造・販売
-
市販後データ収集
-
使用成績評価
-
品質管理体制(QMS)
- 安全管理体制(GVP)
※本サイトのコンテンツは、医療機器開発支援を目的とした一般情報であり、法令遵守や承認取得の保証をするものではありません。最終判断・責任は利用者ご自身で専門家に相談のうえ実施してください。